

Spesso ci si sente proporre dal gommista il “gonfiaggio con azoto”.
I vantaggi che ci promette sono: maggior stabilità della pressione al variare della temperatura, minor perdita di pressione nel tempo, quindi piú affidabilità e ridotta manutenzione. Inoltre – sostengono – si riducono le possibilità di esplosione perché si riduce la corrosione interna del pneumatico dovuta all'aggressività dell'ossigeno.
Vediamo cosa c'è di vero.
In chimica, “azoto” identifica l'elemento, simbolo N, numero atomico 7, peso atomico 14.01, raggio atomico 0.74 Å.
L'azoto cui ci si riferisce comunemente, invece, è la molecola di gas azoto, di formula chimica N2 , e da qui in avanti con il termine azoto mi riferirò sempre all'azoto come gas biatomico.
 I
gas inerti sono i cosiddetti gas nobili (proprio perché non
reagiscono in alcun modo con altri elementi), quali Azoto (N), Elio (He),
Neon (Ne), Argo (Ar), Kripto (Kr), Xeno (Xe) e Radon (Rn). Gli ultimi due
in realtà non sono esattamente inerti, lo Xeno si può far reagire con il
Fluoro, e il Radon è radioattivo.
I
gas inerti sono i cosiddetti gas nobili (proprio perché non
reagiscono in alcun modo con altri elementi), quali Azoto (N), Elio (He),
Neon (Ne), Argo (Ar), Kripto (Kr), Xeno (Xe) e Radon (Rn). Gli ultimi due
in realtà non sono esattamente inerti, lo Xeno si può far reagire con il
Fluoro, e il Radon è radioattivo.
L'azoto è un gas incolore, inodore e insapore; è pochissimo solubile in acqua, con la quale non reagisce. È una molecola biatomica, con un triplo legame fra i due atomi, questo le garantisce una fortissima stabilità, tant'è che per questo è detto gas inerte.
Il gonfiaggio dei pneumatici, secondo quanto dichiarano, non avviene con azoto puro, bensí con una “miscela di gas inerti”, è quindi verosimile pensare che siano presenti anche percentuali dei gas sopraccitati. Cosa ci sia effettivamente dentro, bisognerebbe chiederlo ai distributori delle bombole, anche se, come vedremo, non cambia nulla.
Quando gonfiamo le gomme con l'aria di compressore, quindi con quella atmosferica, pompiamo nel pneumatico una miscela di gas piú o meno cosí composta:
1% altri gas (fra i quali gas nobili, altri gas, vapori vari in particolare d'acqua)
Essenzialmente la differenza fra “miscela di gas inerti” e aria comune può essere riassunta nella presenza in quest'ultima di ossigeno e vapor d'acqua. Vedremo che differenza fanno.
Una delle prime considerazioni che si sentono fare è che “con l'azoto la pressione resta costante piú a lungo perché l'azoto sfugge meno dell'ossigeno attraverso la gomma”.
Questa è ovviamente una sciocchezza, per una serie di motivi. Innanzitutto, la dimensione di una molecola di gas (quale esso sia) è relativamente grande, e non può certo sfuggire attraverso la struttura del reticolo delle fibre della gomma. È una questione strettamente meccanica: immaginatevi una rete (tipo quelle da pesca) che vogliamo riempire con palline (che sarebbero le nostre molecole di gas). Abbiamo palline da tennis e da ping pong : quelle da ping pong sono piú piccole delle maglie e passano: non potrete mai contenere le palline da ping pong in una rete come quella, non è che se ne perda “una ogni tanto”: come le butto nella rete, cadono immediatamente fuori. In questo caso, sarebbe impossibile lo stesso gonfiaggio della gomma, dato che i “pori” sarebbero talmente tanti da interessare l'intera superficie del pneumatico: sarebbe come voler gonfiare un pneumatico fatto di tessuto di cotone!
Le palline da tennis, invece, non passano attraverso le maglie, quindi le potrete contenere senza problemi. E di nuovo, non è che “se ne perda qualcuna ogni tanto”. O passa, oppure non passa.
Ovviamente, se una maglia si rompe, da lí può uscire una pallina da tennis alla volta, e piano piano le perderò tutte. Questo è quello che capita in caso di foratura, che provoca una perdita progressiva del gas. Ma ciò è dovuto al fatto che il “buco” è limitato a una piccolissima porzione della superficie totale.
Le perdite che ci sono avvengono unicamente per sfiati meccanici, ovvero imperfetta tenuta della valvola, o imprecisa tenuta del cerchio, magari dovuta anche a uno stile di guida un po' allegro con “marciapiedate” senza ritegno.
Al proposito, penso sia doveroso far presente che insieme al gonfiaggio con azoto, vengono usualmente sostituite le valvole dei pneumatici con altre “speciali” con guarnizione metallica. Manca la controprova (che nessuno credo abbia ancora fatto) di montare quelle stesse valvole e poi gonfiare la gomma con aria comune, ma esiste il serio sospetto che tutte le “miracolose” diminuzioni delle perdite di pressione piú che all'azoto vadano imputate a quelle valvole di qualità decisamente superiore.
Si sente anche dire che l'ossigeno sfugge attraverso il reticolo della gomma, mentre l'azoto no: gonfiando con aria comune, io perdo quel 20% di ossigeno che è cosí responsabile del progressivo calo di pressione. Anche quest’affermazione è ridicola: se fosse vero, nel momento stesso in cui gonfio la gomma, la pressione “sparerebbe” l'ossigeno fuori dal pneumatico, la cui superficie farebbe né piú né meno l'effetto di un filtro: e dentro mi troverei in brevissimo tempo solo azoto e gli altri gas che non sfuggono. Ma soprattutto è ridicola perché la molecola dei due gas è grande praticamente uguale! Infatti, il raggio molecolare dell'azoto è di 1.8 Å, mentre quella dell'ossigeno è 1.7 Å; l'elio è relativamente molto piú piccolo (1.4 Å), ciononostante era utilizzato (non so se avviene ancora adesso) nel gonfiaggio dei pneumatici delle biciclette da pista, il tutto senza problemi di tenuta nonostante gonfiaggi 12 atm. E se da una camera d'aria non sfugge l'elio a 12 atm, a maggior ragione non sfuggono azoto e ossigeno a meno di 3!
Altre teorie sostengono che l'azoto allunghi la vita delle gomme, perché l'ossigeno che c'è nell'aria aggredisce la parte interna del pneumatico. E che l'ossigeno che ossida la gomma (combinandosi quindi con essa) è il responsabile del calo di pressione che si ha col tempo, poiché la molecola di ossigeno che si combina formando un ossido solido, fa venir meno il suo contributo alla pressione totale, che forzatamente diminuisce. Questo discorso poteva essere vero diverse decine di anni fa, quando le gomme erano di derivazione naturale (e non sintetica), in particolare le camere d'aria che equipaggiavano la totalità dei pneumatici (il tubeless era ancora lontano dal diffondersi). Tant'è che su “Chimica” di Quagliano-Vallarino (Piccin Editore, 1973) alla pag. 647 troviamo scritto testualmente:
“La vita dei pneumatici delle automobili può essere notevolmente allungata gonfiandoli con azoto invece che con aria: in questo modo si previene la corrosione ossidativa delle pareti interne di gomma da parte dell'ossigeno dell'aria, alle alte pressioni e temperature che normalmente si sviluppano nei pneumatici sotto sforzo”.
Venendo un po' di piú ai giorni nostri, però, le cose cambiano. La gomma sintetica è decisamente piú stabile e non presenta questi problemi. Cfr. “Chimica Organica”, di P. Vollhardt, ed. Zanichelli, 1990, pag. 600: “La gomma sintetica: … il 2-cloro-1,3-butadiene può essere polimerizzato in un polimero elastico, resistente al calore e all'ossigeno, detto neoprene…”. La gomma sintetica odierna non risente dell'aggressione ossidativa dell'ossigeno, e tutti i problemi di cui sopra sono superati.
Altri sostengono che gonfiando le gomme col compressore, si pompino all'intero dei vapori d'olio di lubrificazione del compressore, e che siano questi ad aggredire la gomma. Senza dilungarci in complesse analisi di chimica organica, basta limitarsi a notare che non risulta tuttora che ci sia alcuno che abbia mai dovuto cambiare una gomma perché si era “consumata” all'interno...
Come detto, l'azoto sfugge esattamente come l'ossigeno, non esiste quindi alcun motivo sensato per cui l'azoto debba garantire cali di pressione minori nel tempo rispetto all'aria comune (che - per inciso - è formata al 78% da azoto!).
Ma in ogni modo, se anche fosse vero, non controllare le gomme a lungo sarebbe ugualmente un pessimo consiglio. Dalla legge isocora dei gas, otteniamo la seguente relazione:
P1 / T1 = P2 / T2
dove P1 e T1 sono rispettivamente pressione (in atm) e temperatura (in °K) iniziali, e P2 e T2 quelle finali. Supponiamo di gonfiare le nostre gomme d'estate, con 35°C (cioè 308°K), a 2.50 atm. Supponendo che non vi sia la benché minima perdita, quando andrò a misurare la pressione, d'inverno, con 0°C (= 273°K) troverò le mie gomme a:
2.5 / 308 = P2 / 273
che risolta mi fornisce una pressione di 2.25 atm.
Quindi dire che “con l'azoto si può evitare di controllare la pressione perché questa resta stabile” è concettualmente un cattivo consiglio, dato che solo per la variazione di temperatura, il gas (quale esso sia, non importa) comporta una riduzione di 0.25 bar a freddo. Variazione non trascurabile sul comportamento di una gomma. Pertanto, è buona abitudine controllare comunque regolarmente la pressione dei pneumatici, e in ogni modo ogniqualvolta la temperatura atmosferica ha dei cambiamenti importanti.
Uno degli argomenti cardine che propongono i sostenitori dell'azoto è quello secondo il quale il gonfiaggio con azoto garantirebbe una minore variazione della pressione dovuta al riscaldamento della gomma durante la marcia. Alcuni sostengono addirittura che con l'azoto la gomma si scaldi meno. Questa seconda affermazione è ovviamente stupida, il riscaldamento della gomma deriva essenzialmente dall'attrito generato con l'asfalto (e in minima parte dall'irraggiamento dei freni portati ad alta temperatura), condizioni che ovviamente sono indipendenti dal tipo di gas che gonfia il pneumatico.
Quanto al fatto che la variazione di pressione sia minore, è un'affermazione imprecisa, richiede i debiti distinguo. Fondamentalmente, se si vuole trovare un “merito” alle miscele di gas inerti, non è per il comportamento fisico che può avere l'azoto o qualche altro gas (che, come vedremo, si comportano piú o meno tutti uguali), bensí semmai al fatto che sono gas anidri (cioè non contengono vapor d'acqua). Questo fatto è di grande interesse in gomme destinate alle competizioni, che raggiungono temperature parecchio elevate. È invece trascurabili nelle gomme da strada, la cui temperatura resta a valori molto piú bassi.
Ma procediamo con ordine. Partiamo dall'equazione di stato dei gas ideali, che è:
P • V = n • R • T
dove:
P pressione in atm
V volume in litri
N numero moli
R costante (0.082 litri per atm/grado)
T temperatura in gradi Kelvin.
I gas reali, invece, deviano leggermente da questa equazione, che comunque è un'ottima approssimazione per la maggior parte delle esigenze, e presenta il vantaggio di una notevole semplicità di calcolo. Volendo calcolare con esattezza il comportamento dei gas reali, bisogna ricorrere all'equazione corretta secondo Van der Waals, che è:
(P + a • n² / V²) • (V - b) = n • R • T
dove P, n, R e T sono gli stessi di prima, e “a” e “b” sono detti appunto coefficienti correttivi di Van der Waals. Questi coefficienti variano da gas a gas. Sennonché quello che scopriamo è che tali valori sono:
|
per l’azoto: |
a = 1.35 atm * ( l / mole )² |
b = 0.0383 l / mole; |
|
per l’ossigeno: |
a = 1.32 atm * ( l / mole )² |
b = 0.0322 l / mole; |
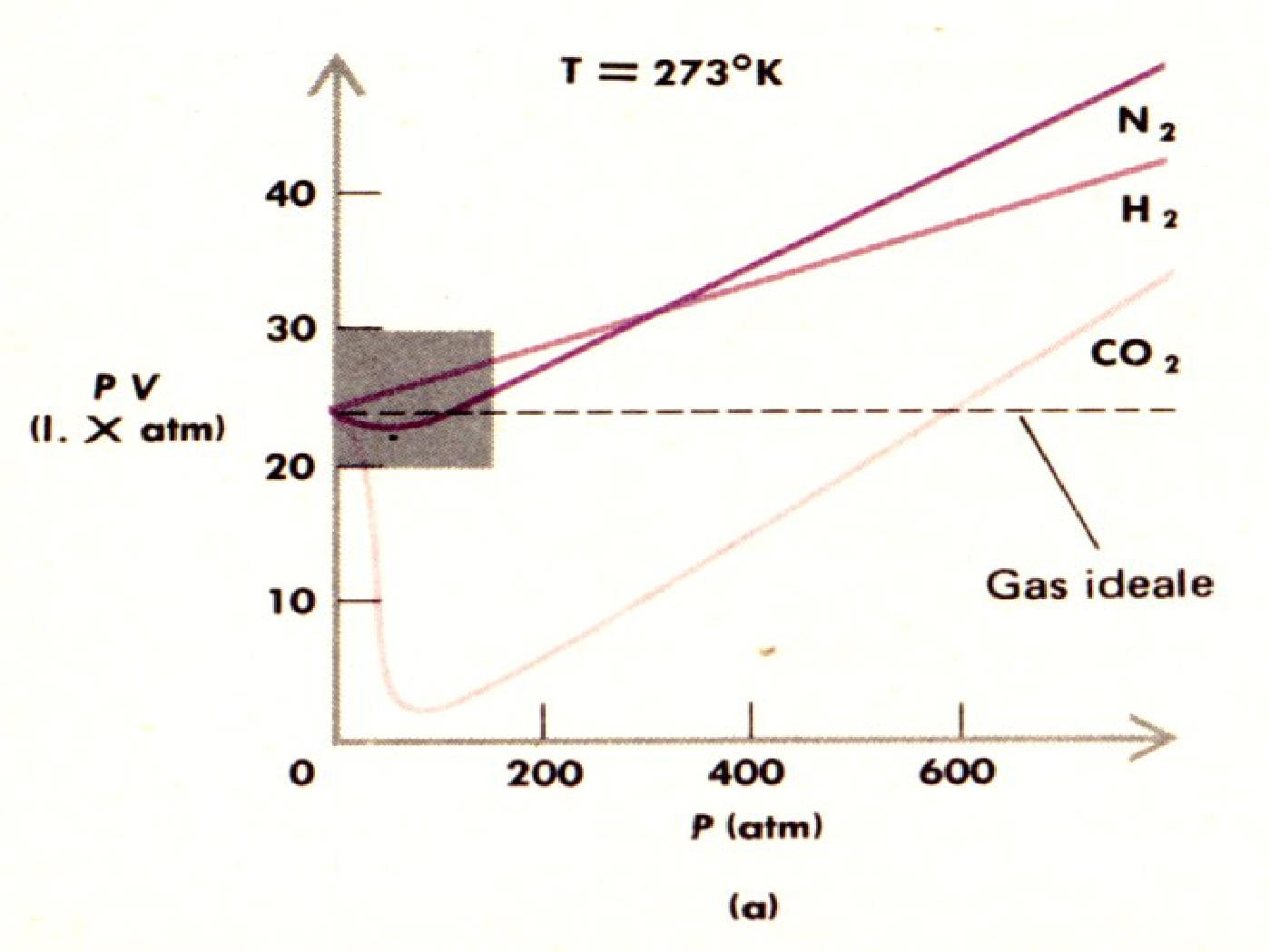
Come si vede, le differenze dei valori per azoto e ossigeno sono trascurabili, e possiamo a buon diritto affermare che le loro variazioni di pressione, all'aumentare della temperatura, sono identiche. Tra tutti e due, poi, formano il 98% dell'aria che respiriamo: avere solo azoto, oppure azoto e ossigeno, non cambia alcunché. Se cambiamenti ci sono, non sono dovuti evidentemente al diverso comportamento di questi due gas, o dalla presenza o meno di uno dei due nella miscela gassosa.
Questa è l'unica affermazione sensata che si può fare sull'azoto. Ed è per questo che l'azoto trova applicazione nelle competizioni piú estreme, laddove il mezzo decimo di bar può far cambiare l'auto da instabile a perfetta. Ma non perché l'azoto faccia variare di meno la pressione, scaldandosi; ma piuttosto perché senza umidità, gli aumenti di pressione dovuti alla temperatura sono piú prevedibili.
Nell'uso quotidiano, ad ogni modo, è un fenomeno assolutamente irrilevante, e questo per un motivo unicamente di temperatura. Non dobbiamo dimenticare, infatti, che le gomme da competizione raggiungo e superano temperature dell'ordine di 130°C; ovviamente sono valori impensabili nelle gomme delle nostre auto!
L'umidità atmosferica è acqua allo stato liquido in sospensione. È un fenomeno che tutti conosciamo, perché quando ce n'è molta, si manifesta sotto forma di nebbia. Gonfiando le gomme con aria comune, ovviamente pompo dentro anche l'acqua in sospensione. Già questo pone un grosso problema di indeterminazione, poiché l'umidità atmosferica (e quindi la quantità di acqua in sospensione nell'aria) è una quantità che varia di giorno in giorno.
L'umidità relativa dell'aria indica il rapporto fra la pressione parziale del vapor d'acqua nell'aria, e la tensione di vapore che avrebbe l'acqua alla stessa temperatura. Cosí, a 25°C, la tensione di vapore dell'acqua è di 24 torr, se l'umidità è del 75% vuole dire che la pressione parziale dell'acqua è di 24×0.75=18 torr. Il grosso problema nasce dal fatto che, aumentando la temperatura, aumenta la tensione di vapore dell'acqua, e conseguentemente la sua pressione parziale. Le cose sono complicate dal fatto che la tensione di vapore dell'acqua ha un comportamento non lineare. A 60°C ha ancora solo 150 torr di pressione parziale (0.2 atm), a 80°C ha 355 torr (poco meno di 0.5 atm), poi a 100° fa il salto ed arriva a 760 torr (1 atm). A 134°C addirittura la tensione di vapore è di circa 1500 torr (2 atm).
Ecco spiegato come mai in F1 è indispensabile togliere l'umidità, per sapere a che pressione avremmo le gomme a caldo, mentre sulle nostre auto cambia poco o nulla: gonfiando a freddo (25°C) le nostre gomme a una pressione iniziale di 2 bar, con un'umidità relativa del 75%, abbiamo la pressione parziale dell'acqua di 18 torr (0.02 atm!). Cioè, di quelle 2 atm, praticamente nulla è dovuto alla parte di umidità che passa allo stato di vapore. Se l'umidità fosse del 40%, la pressione parziale dell'acqua sarebbe 0.01 atm, ovvero non rileveremmo differenza.
A 60°C, le gomme gonfiate con gas anidro (chiamiamolo “azoto", se volete) avranno una pressione di 2.23 atm, secondo la già vista regola isocora dei gas (P1/V1=P2/V2). Quelle gonfiate con aria al 75% di umidità relativa, saranno invece a 2.23+0.2×0.75=2.38 atm, e non credo che cambi la vita di un'automobilista avere 2.38atm piuttosto che 2.23 a caldo. Se poi l'aria atmosferica avesse avuto il 40% di umidità relativa, a 60°C sarebbero a 2.3 atm, e restano tutte differenze pressoché irrisorie. In queste condizioni, capiamo come avere una miscela di gas inerti (ma soprattutto anidri) oppure dell'aria comune faccia ben poca differenza.
Arrivati a 80°C (ma quante gomme da strada arrivano a queste temperature?) la differenza comincia già a farsi sentire, le gomme con azoto sono a 2.37 atm, quelle con la nostra aria atmosferica al 75% di umidità saranno a 2.37+0.5×0.75=2.74 atm, mentre quelle con l'aria al 40% sono a 2.56 atm. La differenza diventa tangibile.
A 130°C (valori esclusivamente toccati da gomme da competizione) le cose cambiano radicalmente. Con aria anidra (azoto, se volete) arrivano a 2.70 atm, con aria al 40% di umidità sarebbero a 3.5 atm, ma con l'aria umida al 75% sarebbero arrivate a 4.45!
Come si vede, la percentuale di umidità dell'aria modifica in modo drastico la pressione delle gomme, trovarsele a 4.5 piuttosto che 2.7 è una differenza spaventosa, a maggior ragione su auto che passano da pole position a metà schieramento per molto meno! Cosí si vede che senza conoscere l'esatta umidità dell'aria con la quale ho gonfiato le gomme, non ho modo di sapere la pressione che raggiungeranno durante l'utilizzo. Eliminare il vapor d'acqua, elimina un grossissimo fattore d’imprevedibilità.
In definitiva si può affermare con cognizione di causa che, sulla vostra auto con la quale andate in ufficio ogni giorno o con la quale anche vi lanciate sui curvoni autostradali a ruote fischianti, l'azoto è un puro capriccio non motivato da alcun fondamento tecnico.
Le variazioni di comportamento rispetto all'aria comune e alle temperature raggiunte dalle gomme da strada, sono talmente insignificanti da non compensare le scomodità cui l'azoto ci costringe, ovvero dovere necessariamente rivolgerci al gommista per controllare la pressione ed eventualmente ripristinarla, piuttosto che poterlo fare presso qualunque benzinaio.
Tanto piú che la gomma non viene mai portata sottovuoto, quando viene poi gonfiata con l'azoto. Una pressione di 2.5 atmosfere effettive significa 3.5 atmosfere assolute, di queste 3.5, la pressione atmosferica è comunque ineliminabile. Quando vado a sgonfiare completamente il pneumatico per gonfiarlo con azoto, in realtà la gomma contiene ancora 1 atmosfera assoluta di aria comune, che in nessun modo si elimina.
Rigonfiando con azoto, ottengo in realtà una miscela formata per circa il 30% da aria comune, e per il 70% da azoto. Pertanto, tutti i problemi creati dall'umidità dell'aria, ce li trasciniamo dietro anche gonfiando le gomme con l'azoto, sia pure in misura ridotta. Per ottenere un risultato efficace, dovrei sgonfiare e rigonfiare con azoto almeno una decina di volte. Poiché nessun gommista fa una cosa del genere, il gonfiaggio con azoto si riduce ad essere una pura manovra commerciale, senza alcun beneficio effettivo sulla guida di tutti i giorni.
L'azoto diventa al contrario indispensabile nelle gomme da competizione, che raggiungono alte temperature, per eliminare il parametro di incertezza rappresentato dall'umidità atmosferica (variabile di giorno in giorno) che renderebbe imprevedibile la pressione raggiunta a caldo.
J. V. Quagliano - L. M. Vallarino, Chimica, ed. Piccin.
P. Vollhardt, Chimica Organica, ed. Zanichelli.
R. Breschi - A. Massagli, Stechiometria, ed. ETS.
Copyright© 1998-2003 "QuattroTempi".

il sito www.giordanobenicchi.it NON ha alcun contatto con il produttore dei veicoli ricreazionali/meccaniche, tutte le informazioni pubblicate nelle pagine di questo sito sono frutto di esperienza personale.